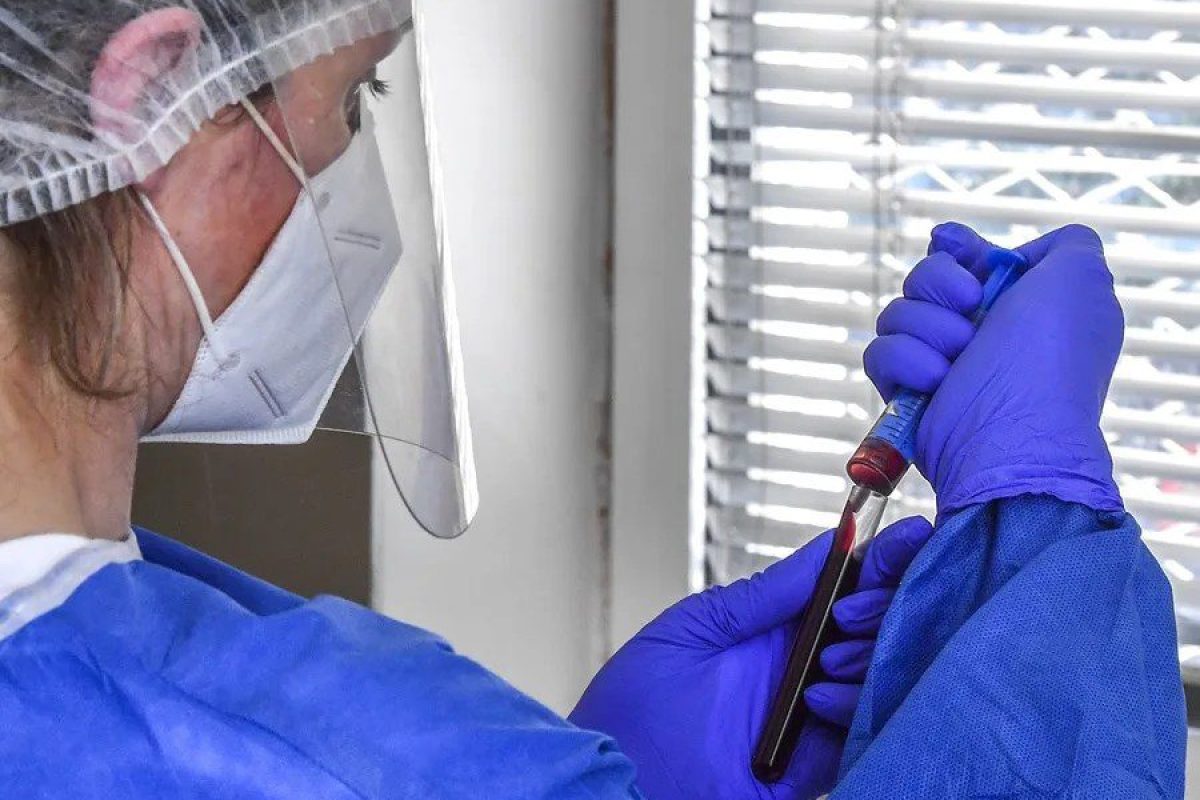
Washington (EFE).- La Administración de Alimentos y Medicamentos (FDA) de EE.UU. anunció este viernes la aprobación del primer sistema de testado que permite detectar en muestras de sangre los niveles de dos proteínas asociadas con el desarrollo de la enfermedad de Alzheimer.
El test Lumipulse G de proporción de pTau217/ß-Amiloide 1-42 en plasma ayuda a la detección temprana en pacientes de más de 55 años del posible desarrollo de placas amiloides en el cerebro, unos depósitos de proteínas cuya aparición se relaciona con la degeneración neuronal propia del alzhéimer.
Aunque las placas amiloides se asocian también con otras enfermedades, su presencia es un signo distintivo del alzhéimer y su detección más común es mediante tomografías por emisión de positrones (TEP), una opción costosa y que implica exponerse a radiación.
A su vez la detección de las proteínas pTau217 y β-Amiloide 1-42, dos biomarcadores asociados al desarrollo de placas amiloides en el cerebro, es posible mediante el análisis de líquido cefalorraquídeo (LCR), que se obtiene mediante una punción lumbar, proceso invasivo y doloroso.
¿Cómo funciona el nuevo test de detección del alzhéimer?
El test recién aprobado permite detectar los niveles de estas dos proteínas en el plasma con una simple extracción de sangre y reduce a su vez la necesidad de someterse a un TEP, contribuyendo a posibles diagnósticos más tempranos.
Para dar luz verde a este kit de testado la FDA evaluó los datos de un estudio clínico en el que se emplearon 499 muestras individualizadas de sangre de pacientes adultos con discapacidad cognitiva.
Menos del 20 % de las muestras testadas obtuvieron resultados poco concluyentes, mientras que en el 91,7 % de las personas que dieron positivo en la presencia de altos niveles de las dos proteínas mencionadas se confirmó también la existencia de placas amiloides mediante TEP o de las mencionadas proteínas mediante un test de LCR.
El 97,3 % de los que obtuvieron un resultado negativo tuvieron también resultados negativos en las otras dos pruebas.
La FDA insiste en cualquier caso en que el sistema, desarrollado por el laboratorio japonés de biotecnología Fujirebio y destinado a pacientes con síntomas de deterioro cognitivo, no puede constituir una prueba de diagnóstico única, por lo que sus resultados deben combinarse con otras pruebas o evaluaciones adicionales.
Fuente: Noticia original